|
Лекция посвящена одному из важнейших физических методов исследования строения вещества – методу дипольных моментов. Рассмотрена природа дипольного момента и методы его определения, а также приведены отдельные примеры применения метода дипольных моментов для выяснения строения химических соединений.
Дипольный момент – важная молекулярная константа, характеризующая электрическую симметрию молекулы. Знание величины дипольного момента необходимо для изучения природы химической связи, оценки прочности донорно-акцепторных и межмолекулярных связей, для квантово-химических расчетов. По величине дипольного момента можно судить об изомерии и конформации органических соединений, конфигурации координационных узлов комплексов, о взаимном влиянии атомов и связей в молекуле. Величина электрического дипольного момента (μ) определяется соотношением:
где l - радиус-вектор, направленный от центра тяжести отрицательного электрического заряда к центру тяжести положительного заряда, абсолютная величина каждого заряда равна q. В химической литературе, так же как и в настоящей лекции, принято противоположное направление вектора дипольного момента. По порядку величины дипольный момент в системе CGSE равен заряду электрона (4.8·10-10 эл.-ст. ед.), умноженному на расстояние в 1Å (10-8 см), что составляет 4.8·10-18 эл.-ст. ед. Принято измерять дипольные моменты в единицах Дебая: 1 D = 1·10-18 эл.-ст. ед. В системе единиц СИ 1 D = 3.34·10-30 Кл*м. Причиной появления дипольного момента являются несколько факторов. В первую очередь – это различия в природе составляющих молекулу атомов. В простейшем случае для двухатомной молекулы μ = 0, если она состоит из двух одинаковых атомов. Это относится к H2, O2, N2 и т.д. В двухатомной молекуле с атомами разной природы проявляется постоянный дипольный момент, т. к., вследствие разной электроотрицательности, характеризующей способность атома оттягивать электронную плотность, появляется асимметрия электронной плотности. Другие причины – разные гибридные состояния орбиталей атомов. Так, например, для связи H-Cl, образованной 1s-орбиталью водорода и 3p-орбиталью хлора, вследствие различной формы s- и p-орбиталей, центр тяжести заряда перекрывания смещен в сторону водорода на ΔL, за счет чего возникает дополнительный, т. н. гомеополярный дипольный момент (рис.1): Рис. 1. Схема происхождения гомеополярного диполя. Методы определения дипольных моментов основаны на нахождении ориентационного эффекта (за исключением метода молекулярного пучка) полярных молекул в приложенном электрическом поле. При этом следует учитывать, что если молекула является полярной и обладает дипольным моментом, то он называется постоянным или собственным дипольным моментом (μo). А при поляризации молекул в электрическом поле возникает индуцированный дипольный момент молекулы (μg). В статических полях или полях с относительно низкими частотами колебаний происходит поляризация вещества в целом, включающая также некоторое смещение ядер и ориентацию молекул вдоль поля, и возникает индуцированный ориентационный дипольный момент молекул (μr), который зависит от μo и из которого можно определить постоянный дипольный момент молекулы μo. Для точных измерений μo малых молекул применяются методы, основанные на микроволновой спектроскопии и молекулярных пучков. Особенно распространен метод Штарка, основанный на эффектах расщепления и сдвига спектральных линий в электрическом поле. Для линейных молекул известны точные выражения, связывающие дипольный момент со штарковским расщеплением линий вращательных спектров. Этот метод дает наиболее точные значения величины дипольного момента (до 10-4 D), причем экспериментально определяется не только величина, но и направление вектора дипольного момента. Важно, что точность определения дипольного момента почти не зависит от его абсолютной величины. Это позволило получить весьма точные значения очень малых дипольных моментов ряда молекул углеводородов, которые нельзя надежно определить другими методами. Так, дипольный момент пропана равен 0.085±0.001 D, пропилена – 0.364±0.002 D, пропина – 0.780±0.001 D, толуола – 0.375±0.01 D, азулена – 0.796±0.01 D. Область применения метода микроволновой спектроскопии ограничена небольшими молекулами, не содержащими атомов тяжелых элементов. Из всех методов получили наиболее широкое распространение методы определения дипольных моментов, основанные на измерении диэлектрической проницаемости (ε) вещества. Этими методами измерены дипольные моменты молекул более 10000 веществ. Переход от измеряемого значения ε газа, чистой жидкости или разбавленного раствора, т.е. макроскопической характеристики диэлектрика, к величине дипольного момента основан на теории поляризации диэлектриков. Считается, что при наложении электрического поля на диэлектрик его полная поляризация Р складывается из наведенной или индуцированной поляризации Рм и поляризации Рор и связана с μ уравнением Ланжевена-Дебая (2).
где М – молекулярная масса, d – плотность, α - поляризуемость молекулы, NA - число Авогадро, k – постоянная Больцмана, Т – абсолютная температура.
где Р1,2, Р1, Р2 – молекулярные поляризации раствора, растворителя и растворенного вещества соответственно; С учетом уравнения (2) уравнение (3) для раствора будет выглядеть как (4):
где М1 и М2 – молекулярные веса растворителя и растворенного вещества;
Величину дипольного момента рассчитывают из уравнения Дебая (2)
из которого, подставляя значения N, κ, π, можно вычислить величину постоянного дипольного момента по формуле (5):
Найденное в эксперименте значение Р2∞ включает в себя электронную (Рэл) и атомную (Рат) молекулярные поляризации и поэтому Рор в уравнении (5) вычисляется как Рор = Р2∞ – Рат – Рэл. Рэл считают равной рефракции вещества, которое вычисляется по той же схеме аддитивности на основании измерения коэффициентов преломления и плотности той же серии растворов, а Рат вследствие ее малости очень часто пренебрегают. Следует отметить, что Рэл можно рассчитать по рефракциям связей и групп, если не требуется высокая точность в значении дипольного момента. Сходимость результатов, полученных различными методами при корректном использовании правильных расчетных формул бывает достаточно хорошей, как показано в табл. 1: Таблица 1. Дипольные моменты молекул (в D)
Исследование большинства структурных проблем, проводимое с помощью данных о дипольных моментах молекул, основывается на сопоставлении экспериментальных величин дипольных моментов с величинами, рассчитанными по аддитивной схеме. Принципиальная идея последней была предложена в 1923 году Томсоном, который указал, что дипольный момент многоатомной молекулы m можно рассматривать как результат векторного сложения дипольных моментов, принадлежащих отдельным связям. Для молекулы, содержащей n связей различных типов,
где μi – момент, характеризующий i-ю связь.
2 μO-H cos 52° = 1.84 D.
3
μN-H cos 68° = 1.46
D.
Имеются таблицы групповых моментов, где за величину группового момента в ароматическом ряду принимается значение дипольного момента монозамещенного бензола, а в алифатическом – соответствующего монозамещенного метана. В таблице 2 в качестве примера приведены лишь некоторые групповые моменты. Таблица 2. Групповые моменты (бензол, 25 оС).
Θ - угол между вектором группового момента и связью Х-С.
Более сложным метод расчета выглядит для молекул, содержащих произвольное число жестко закрепленных полярных групп. Для них чаще всего применяется способ расчета через проекции вектора дипольного момента на произвольно выбранные оси координат (8):
При этом под mx, my, mz подразумеваются суммы проекций на эту ось векторов всех групповых моментов. В качестве примера рассмотрим расчет дипольного момента 4,5-дихлор-1,3-бис-трифторметил-бензола:
CF3 (1) mx = 2.54 *; my = 0. * Положительное значение m связи указывает на то, что m связи направлен по оси координат, а отрицательное – против.
Естественно, если молекулы неплоские, то следует найти проекции векторов на соответствующие плоскости. Существенно усложняется расчет, если молекула содержит несколько свободно или заторможенно вращающихся полярных групп. Здесь применяются специальные подходы, описанные в монографиях. Если молекулы некоторых соединений существуют в растворах или в газовой фазе в виде равновесной смеси двух или нескольких молекулярных форм: таутомеров, конформеров, мономеров и димеров, то экспериментально определяемый дипольный момент является в этом случае усредненной величиной. связанной с дипольными моментами индивидуальных форм соотношением (9):
где Ni и μi – соответственно мольные доли и дипольные моменты таутомера, конформера и др.
μвыч = 3.47 D.
μвыч = 5.59
D.
μвыч = 4.01
D.
μвыч = 4.01 D. Воспользовавшись значениями групповых моментов из таблицы 2 и рассчитав теоретические величины дипольного момента каждого конформера, получим: μ2 = 0.25 (3.47)2 +
0.25 (5.59)2 + 0.25 (4.01)2 + 0.25 (4.01)2 Полученное значение близко к опытной величине 4.56 D (бензол, 18
°С) Читать
дальше:
|
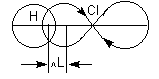
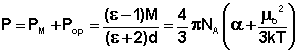 (2)
(2)





