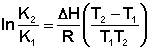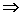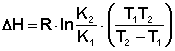|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов химического факультета Работа № 3 Задания к работе 1. Изучить изменение концентрации иода во времени в ходе обратимой реакции восстановления железа(III) иодидом калия в двух растворах с различными начальными концентрациями реагентов при двух температурах. По полученным данным построить кинетические кривые реакции. 2. Рассчитать равновесные концентрации исходных веществ и продуктов реакции для каждого случая. 3. Рассчитать величины концентрационных констант равновесия для каждого случая, сравнить полученные значения. 4. На основании температурной зависимости константы равновесия рассчитать тепловой эффект реакции. 5. Вычислить предельную погрешность определения константы равновесия.
В данной работе химическое равновесие изучается на примере обратимой реакции
Или в ионной форме
Опыт проводится при двух температурах, указанных преподавателем. Для выполнения работы берут четыре сухие колбы с притёртыми пробками ёмкостью 100 мл. Пронумеровав колбы, наливают в них из бюреток следующие количества растворов реагентов:
Затем колбы помещают в водяной термостат при температуре 25 °С (или другой, указанной преподавателем) на 30 мин. Для остановки реакции при титровании приготавливают охлаждённую до 0 °С дистиллированную воду. После термостатирования растворов сливают вместе содержимое колб №№ 1 и 2, а через 10 минут – содержимое колб №№ 3 и 4. Колбы со смешанными растворами плотно закрывают пробками и вновь помещают в термостат. Первая проба для титрования отбираются из каждой колбы через 30 минут после смешивания растворов. В коническую колбу ёмкостью 100 мл наливают 50 мл ледяной дистиллированной воды. Не вынимая колбу, в которой протекает реакция, из термостата, отбирают из неё пипеткой 15 мл раствора и выливают пробу в приготовленную колбу с ледяной водой. Немедленно после выливания пробы образовавшийся в ходе реакции иод титруют 0.015 М раствором тиосульфата натрия Na2S2O3. При титровании раствор тиосульфата прибавляется до бледно-жёлтой окраски раствора, затем добавляется 3-5 капель раствора крахмала и продолжается титрование до исчезновения синего окрашивания (поскольку при выливании пробы в ледяную воду реакция не останавливается, а лишь замедляется, через некоторое время после завершения титрования синяя окраска раствора появляется вновь).
Отбор пробы из каждой колбы и её титрование осуществляется каждые 30 минут до тех пор, пока на титрование двух последовательных проб из данной колбы не будет затрачен одинаковый объём раствора тиосульфата. Прекращение увеличения концентрации
иода указывает на достижение равновесия в реакции. Для расчёта равновесных концентраций реагентов используют объём раствора тиосульфата
Результаты эксперимента представляют в виде таблиц, подобных приведенной ниже:
1. Концентрация иода
2. Концентрация ионов Fe2+ равна удвоенной концентрации иода:
3. Концентрация ионов Fe3+ равна разности начальной концентрации FeCl3 и равновесной концентрации ионов Fe2+:
Концентрация FeCl3 вычисляется из концентрации исходного раствора
Здесь a и b – объёмы растворов соответственно FeCl3 и KI, взятых для проведения реакции.
4. Равновесная концентрация иодид-иона
Расчёт константы равновесия для каждого из растворов проводится по формуле:
Средняя константа равновесия при данной температуре вычисляется как полусумма значений Кс, полученных для каждого из приготовленных растворов. Аналогичным образом проводится опыт при температуре 40 °С (или другой, указанной преподавателем). Результаты расчётов константы равновесия представляют в виде таблицы, подобной приведенной ниже:
№ 1. Калориметрическое определение теплоты растворения № 2. Калориметрическое определение теплоты нейтрализации № 3. Изучение равновесия гомогенной химической реакции в растворе № 4. Градуировка термопары № 5. Построение диаграммы плавкости двухкомпонентной системы № 6. Определения коэффициента распределения вещества между двумя жидкими фазами № 7. Изучение равновесия жидкий раствор – пар в бинарных системах № 8. Определение молекулярной массы растворенного вещества криоскопическим методом № 9. Определение степени диссоциации электролита криоскопическим методом № 10. Определение константы скорости гидролиза сахарозы № 11. Определение константы скорости и энергии активации реакции иодирования ацетона № 12. Определение константы скорости и энергии активации реакции гидролиза уксусного ангидрида № 13. Определение молярной рефракции вещества © Кафедра физической и коллоидной химии ЮФУ (РГУ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
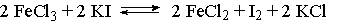
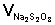 , затраченный на титрование пробы в момент равновесия (т.е. на титрование последней пробы).
, затраченный на титрование пробы в момент равновесия (т.е. на титрование последней пробы).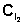 :
: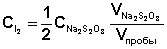
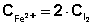
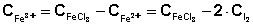
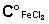 и степени его разбавления при смешении с раствором
иодида калия:
и степени его разбавления при смешении с раствором
иодида калия: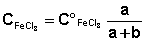
 вычисляется, исходя из концентрации исходного раствора
вычисляется, исходя из концентрации исходного раствора
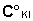 и равновесной концентрации
иода:
и равновесной концентрации
иода: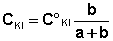
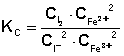
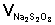 ,
мл
,
мл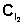 ,
моль/л
,
моль/л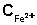 ,
моль/л
,
моль/л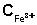 ,
моль/л
,
моль/л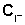 ,
моль/л
,
моль/л