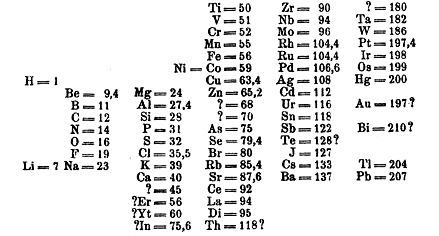|
Учебное пособие для студентов химфака РГУ
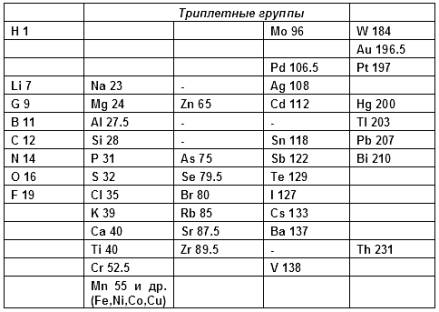
5.1. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Первые попытки систематизации – Таблица Ньюлендса – Таблица Мейера – Таблица Менделеева – Развитие периодического закона Первые попытки систематизации элементов Одной из важнейших проблем теоретической химии XIX века после разрешения проблемы атомных весов оставалась систематизация химических элементов, число которых постоянно росло. Со времён античности и средних веков были известны 14 элементов (хотя собственно элементами их стали считать лишь в конце XVIII века). В XVIII веке к ним добавилось 20 новых элементов; к 1860 году число известных элементов возросло до шестидесяти. Проблема упорядочения элементов и отыскания закономерности в изменении их свойств становилась всё более актуальной. Создание периодической системы химических элементов стало результатом многолетней работы многих химиков. Первую попытку систематизации элементов предпринял немецкий химик Иоганн Вольфганг Дёберейнер, сформулировавший в 1829 г. закон триад. Дёберейнер обратил внимание на то, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы. В выделенных Дёберейнером триадах элементов атомный вес среднего элемента триады примерно равен полусумме атомных весов двух крайних элементов:
Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений.
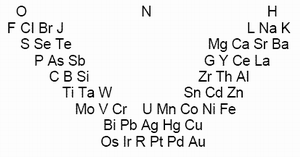
Необходимым этапом систематизации элементов стала их химическая классификация, важнейший вклад в которую внёс немецкий химик Леопольд Гмелин. В 1843 г. Гмелин опубликовал таблицу химически сходных элементов, расставленных по группам в порядке возрастания "соединительных масс". Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов (по терминологии Берцелиуса), т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз. Следующим шагом на пути к открытию периодического закона стали т.н. дифференциальные системы, направленные на выявление общих закономерностей в изменении атомного веса элементов. В 1850 г. немецкий врач Макс фон Петтенкофер попытался найти у элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т.е. в рядах соединений, отличающихся друг от друга группой CH2. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную восьми. На этом основании Петтенкофер высказал предположение, что элементы, возможно, являются сложными образованиями каких-то субэлементарных частиц. На следующий год подобные соображения высказал и французский химик-органик Жан Батист Андрэ Дюма. Различные варианты дифференциальных систем предложили немецкий химик Эрнст Ленсен (1857), американец Джосайя Парсонс Кук (1857), английские химики Уильям Одлинг (1858) и Джон Холл Глэдстон (1859). В 1859 г. эту идею детально разработал немецкий учёный Адольф Штреккер.
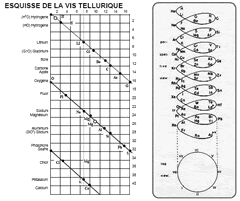
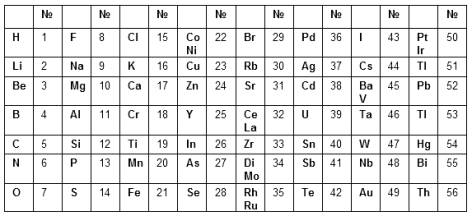
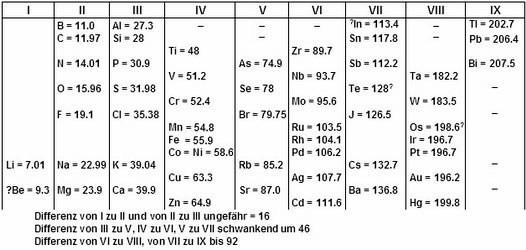
Дальнейшим развитием дифференциальных систем стали периодические классификации 1860-х годов. Александр Эмиль Бегуйе де Шанкуртуа в 1862 г. предложил винтовой график элементов, расположенных в порядке возрастания атомных весов – т. н. "земная спираль" (vis tellurique). Шанкуртуа нанёс на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие элементам. Таким образом, элементы, атомные веса которых отличались на 16, или на число, кратное 16, располагались на одной вертикальной линии. При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной прямой. Винтовой график Шанкуртуа фиксировал закономерные отношения между атомными массами элементов, однако данная система не могла быть признана удовлетворительной. Джон Александр Рейна Ньюлендс в 1864 г. опубликовал таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест. Вследствие присущих системе Ньюлендса недостатков современники отнеслись к закону октав весьма скептически. В том же году Уильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил следующую таблицу, не сопровождаемую какими-либо пояснениями: Несколько попыток систематизации элементов предпринял в 60-е годы XIX века немецкий химик Юлиус Лотар Мейер. В 1864 г. Мейер опубликовал в своей книге «Новейшие теории химии и их значение для химической статики» таблицу, в которую были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в этой таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах подобных элементов (соотношения атомных масс и валентностей ещё 22 элементов рассматривались в другой таблице).
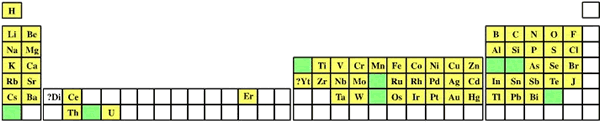
Объединённая таблица, подготовленная им в 1868 г. для второго издания своей книги, была опубликована лишь в 1895 г.; в ней 52 элемента размещались в 15 столбцах. Следующую таблицу Мейер предложил в вышедшей в 1870 г. статье, содержавшая также график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид. Таблица "Природа элементов как функция их атомного веса" состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными. Важнейший вклад в систематизацию элементов внёс русский химик Дмитрий Иванович Менделеев, который в марте 1869 г. представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях: 1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств; 2. Сходные по свойствам элементы имеют или близкие атомные веса (Ir, Pt, Os), или последовательно и однообразно увеличивающиеся (K, Rb, Cs); 3. Сопоставление элементов или их групп по величине атомного веса отвечает их т.н. атомности; 4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами; 5. Величина атомного веса определяет характер элемента; 6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с паем (атомной массой) 65-75; 7. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента. Так, пай Te должен быть не 128, а 123-126. В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева. В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций).
В 1871 г. Менделеев в итоговой статье "Периодическая законность химических элементов" дал формулировку Периодического закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса. Тогда же Менделеев придал своей периодической таблице классический вид (т. н. короткая таблица). В связи с периодической таблицей химических элементов часто поднимается вопрос о приоритете, который по-разному рассматривается в отечественной и зарубежной литературе. В российских источниках подчёркивается определяющая роль Менделеева и обычно отрицается существенный вклад Мейера в создание периодической системы элементов. Большинство зарубежных историков химии считают, что все обсуждаемые выше таблицы 1860-х годов можно считать периодическими. Обычно (и вполне обоснованно) утверждается, что Шанкуртуа, Ньюлендс, Одлинг, Мейер и Менделеев независимо друг от друга пришли к идее периодичности, причём наибольший вклад в развитие идеи внесли Менделеев и Мейер. Следует упомянуть, что Лондонское королевское общество в 1882 г. присудило золотые медали имени Дэви совместно Д. И. Менделееву и Л. Мейеру с формулировкой "За открытие периодических соотношений атомных весов"; в 1887 г. этой награды был удостоен ещё и Дж. Ньюлендс. При этом роль Менделеева в зарубежной историографии химии никоим образом не принижается, а напротив, подчёркивается, что введение термина "периодичность", формулировка периодического закона и предсказание свойств неоткрытых элементов являются его исключительной заслугой. Сам Мейер всегда добросовестно ссылался на труды Менделеева и признавал его важнейшие заслуги в создании периодической системы. Тем не менее работы Л. Мейера, посвящённые периодичности элементов, никоим образом не являются заимствованными, а его вклад в создание периодической системы элементов несомненно весьма и весьма значителен. Особая заслуга Менделеева состоит в том, что он не просто расположил элементы в определённом порядке, но представил эти закономерности как общий закон природы. На основании предположения, что атомная масса предопределяет свойства элемента, Менделеев взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов – прежде всего экабора, экаалюминия и экасилиция. Сам учёный по этому поводу высказался следующим образом: "Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и не ожидаемых, и оправдание тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны вывел из него такие логические следствия, которые могли показать – верен ли он или нет. Без такого способа испытания не может утвердиться ни один закон природы". Развитие периодического закона Формулировка Менделеевым периодического закона и построение периодической таблицы означали лишь начало развития учения о периодичности свойств элементов. Предсказания Менделеева вначале были встречены с известным скепсисом; лишь после того, как были открыты предсказанные элементы, и обнаружено совпадение их реальных свойств с предсказанными, периодический закон был признан в качестве одного из фундаментальных законов химии. В развитии периодического закона принято выделять два этапа – химический и физический. Химический этап развития периодического закона начался с открытия предсказанных элементов. В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл новый элемент, который был назван галлием. Менделеев сразу же указал, что галлий представляет собой экаалюминий. Дальнейшие исследования полностью подтвердили это, причём оказалось, что Менделеев предсказал плотность галлия точнее, чем Лекок де Буабодран экспериментально определил её. В 1879 г. шведский химик Ларс Фредерик Нильсон опубликовал сообщение об открытии скандия, свойства которого в точности соответствовали свойствам менделеевского экабора. В 1886 г. немецкий химик Клеменс Александр Винклер открыл германий. Исследование свойств нового элемента показало, что он полностью идентичен с экасилицием (сам Менделеев поначалу счёл новый элемент "экакадмием"; на тождественность германия и экасилиция первым указал Л. Мейер). Полное подтверждение предсказаний Менделеева означало торжество периодического закона. С середины 1880-х годов учение о периодичности было окончательно признано в качестве одной из основ теоретической химии. Тем не менее, в периодическом законе оставались некоторые проблемы. Предстояло определиться с местом в периодической таблице для двух групп элементов – инертных газов, имеющих нулевую валентность, и тринадцати редкоземельных элементов. Нельзя не упомянуть о том, что открытие большого числа элементов во второй половине XIX века было в значительной мере обусловлено появлением спектрального анализа, метода, который предложили в конце 1850-х годов немецкие учёные Густав Роберт Кирхгоф и Роберт Вильгельм Бунзен. В 1900-1902 гг. Д. И. Менделеев, Уильям Рамзай, первооткрыватель инертных газов, и Богуслав Браунер, известный своими работами по уточнению атомных масс химических элементов, произвели модернизацию периодической таблицы. Менделеев и Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы. Нулевая группа прекрасно вписалась в периодическую таблицу; инертный газ явился элементом, переходным между галогенами и щелочными металлами. Браунер предложил решение проблемы размещения в таблице редкоземельных элементов. По его мнению, РЗЭ составляют особую группу периодической системы: "Подобно тому, как в Солнечной системе целая группа астероидов занимает полосу на месте пути, по которому должна бы двигаться одна планета, так точно целая группа элементов редких земель могла бы занять в системе одно место, на котором в другом случае стоит один элемент... Таким образом, все эти элементы, очень подобные один другому, стали бы на том месте в IV группе восьмого ряда, которое до сих пор занимал церий... Элементы редких земель создали бы особую интерпериодическую группу, аналогичную до некоторой степени восьмой группе, поместившись в середине остальных групп периодической системы..." Шестой период таблицы, таким образом, должен быть длиннее, чем четвёртый и пятый, которые в свою очередь длиннее, чем второй и третий периоды. В коротком варианте периодической таблицы Браунер предложил поместить все РЗЭ в одну клетку четвёртой группы. Модернизация периодической системы в начале XX века завершила химический этап её развития. Химия в принципе не могла объяснить причину периодичности свойств элементов и их соединений. Дальнейшее развитие периодического закона в XX веке связано с блестящими успехами физики, приведшими к революционным изменениям в естествознании. Физический этап развития периодического закона можно в свою очередь разделить на несколько стадий: 1. Установление делимости атома на основании открытия электрона и радиоактивности (1896 – 1897); 2. Разработка моделей строения атома (1911 – 1913); 3. Открытие и разработка системы изотопов (1913); 4. Открытие закона Мозли (1913), позволяющего экспериментально определять заряд ядра и номер элемента в периодической системе; 5. Разработка теории периодической системы на основании представлений о строении электронных оболочек атомов (1921 – 1925); 6. Создание основ квантовой теории периодической системы (1926 – 1932). Подробно эти этапы развития физики и химии будут рассмотрены в главе "Химия ХХ века". |