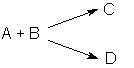|
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ Конспект лекций для студентов биофака ЮФУ (РГУ) 2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Скорость реакции – Порядок реакции – Методы определения порядка реакции – Сложные реакции – Влияние температуры на константу скорости – Обратимые и гетерогенные реакции – Фотохимические реакции – Катализ 2.1.7 Сложные реакции Сложными называют химические реакции, протекающие более чем в одну стадию. Рассмотрим в качестве примера одну из сложных реакций, кинетика и механизм которой хорошо изучены: 2НI + Н2О2 ––> I2 + 2Н2О Данная реакция является реакцией второго порядка; её кинетическое уравнение имеет следующий вид:
Изучение механизма реакции показало, что она является двухстадийной (протекает в две стадии): 1) НI + Н2О2 ––> НIО + Н2О 2) НIО + НI ––> I2 + Н2О Скорость первой стадии V1 много больше скорости второй стадии V2 и общая скорость реакции определяется скоростью более медленной стадии, называемой поэтому скоростьопределяющей или лимитирующей. Сделать вывод о том, является реакция элементарной или сложной, можно на основании результатов изучения её кинетики. Реакция является сложной, если экспериментально определенные частные порядки реакции не совпадают с коэффициентами при исходных веществах в стехиометрическом уравнении реакции; частные порядки сложной реакции могут быть дробными либо отрицательными, в кинетическое уравнение сложной реакции могут входить концентрации не только исходных веществ, но и продуктов реакции. 2.1.8 Классификация сложных реакций Последовательные реакции. Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом: А ––> В ––> С ––> ... Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным. Параллельные реакции. Параллельными называют химические реакции, в которых одни и те же исходные вещества одновременно могут образовывать различные продукты реакции, например, два или более изомера:
Сопряжённые реакции. Сопряжёнными принято называть сложные реакции, протекающие следующим образом: 1) А + В ––> С 2) А + D ––> Е, причём одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой. Вещество А, общее для обеих реакций, носит название актор, вещество В – индуктор, вещество D, взаимодействующее с А только при наличии первой реакции – акцептор. Например, бензол в водном растворе не окисляется пероксидом водорода, но при добавлении солей Fe(II) происходит превращение его в фенол и дифенил. Механизм реакции следующий. На первой стадии образуются свободные радикалы: Fe2+ + H2O2 ––> Fe3+ + OH– + OH• которые реагируют с ионами Fe2+ и бензолом: Fe2+ + OH• ––> Fe3+ + OH– C6H6 + OH• ––> C6H5• + H2O Происходит также рекомбинация радикалов: C6H5• + OH• ––> C6H5ОН C6H5• + C6H5• ––> C6H5–C6H5 Т.о., обе реакции протекают с участием общего промежуточного свободного радикала OH•. Цепные реакции. Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны три типичные стадии, которые мы рассмотрим на примере фотохимической реакции образования хлороводорода. 1. Зарождение цепи (инициация): Сl2 + hν ––> 2 Сl• 2. Развитие цепи: Н2 + Сl• ––> НСl + Н• Н• + Сl2 ––> НСl + Сl• Стадия развития цепи характеризуется числом молекул продукта реакции, приходящихся на одну активную частицу – длиной цепи. 3. Обрыв цепи (рекомбинация): Н• + Н• ––> Н2 Сl• + Сl• ––> Сl2 Н• + Сl• ––> НСl Обрыв цепи возможен также при взаимодействии активных частиц с материалом стенки сосуда, в котором проводится реакция, поэтому скорость цепных реакций может зависеть от материала и даже от формы реакционного сосуда. Реакция образования хлороводорода является примером неразветвленной цепной реакции – реакции, в которой на одну прореагировавшую активную частицу приходится не более одной вновь возникающей. Разветвленными называют цепные реакции, в которых на каждую прореагировавшую активную частицу приходится более одной вновь возникающей, т.е. число активных частиц в ходе реакции постоянно возрастает. Примером разветвленной цепной реакции является реакция взаимодействия водорода с кислородом: 1. Инициация: Н2 + О2 ––> Н2О + О• 2. Развитие цепи: О• + Н2 ––> Н• + ОН• Н• + О2 ––> О• + ОН• ОН• + Н2 ––> Н2О + Н• |